Atomul (din grecescul “atomos” – “ceea ce nu poate fi divizat”) este cea mai mica parte a unui element chimic, care mai pastreaza caracteristicile acestuia. Denumirea i-a fost data de filozoful grec Democrit, in anul 420 i.Hr. Pana la identificarea modelului atomic, gandirea stiintifica a parcurs un drum lung, care incepe in antichitate si inca nu s-a incheiat. Multa vreme s-a crezut ca atomul este sferic si elastic, cu o structura umpluta cu materie, care se supunea regulilor mecanicii clasice. Au trecut secole pana cand, in 1805, chimistul si fizicianul englez John Dalton confirma existenta atomului si propune modelul “bilei de biliard”. In 1881, fizicianul Joseph John Thomson descopera unul dintre constituentii atomului – o particula elementara negativa pe care a denumit-o electron. Tot el, mai tarziu, in 1904, a dezvoltat teoria potrivit careia atomii constau intr-o structura sferica, neutra din punct de vedere electric, ceea ce insemna ca acestia contineau atat incarcaturi pozitive, cat si negative. Cu alte cuvinte, Thomson presupune ca incarcatura negativa a electronilor trebuie sa fie compensata de una pozitiva, care ar putea fi repartizata intr-un mic volum in forma de sfera (modelul atomic “pudding” – “budinca”).
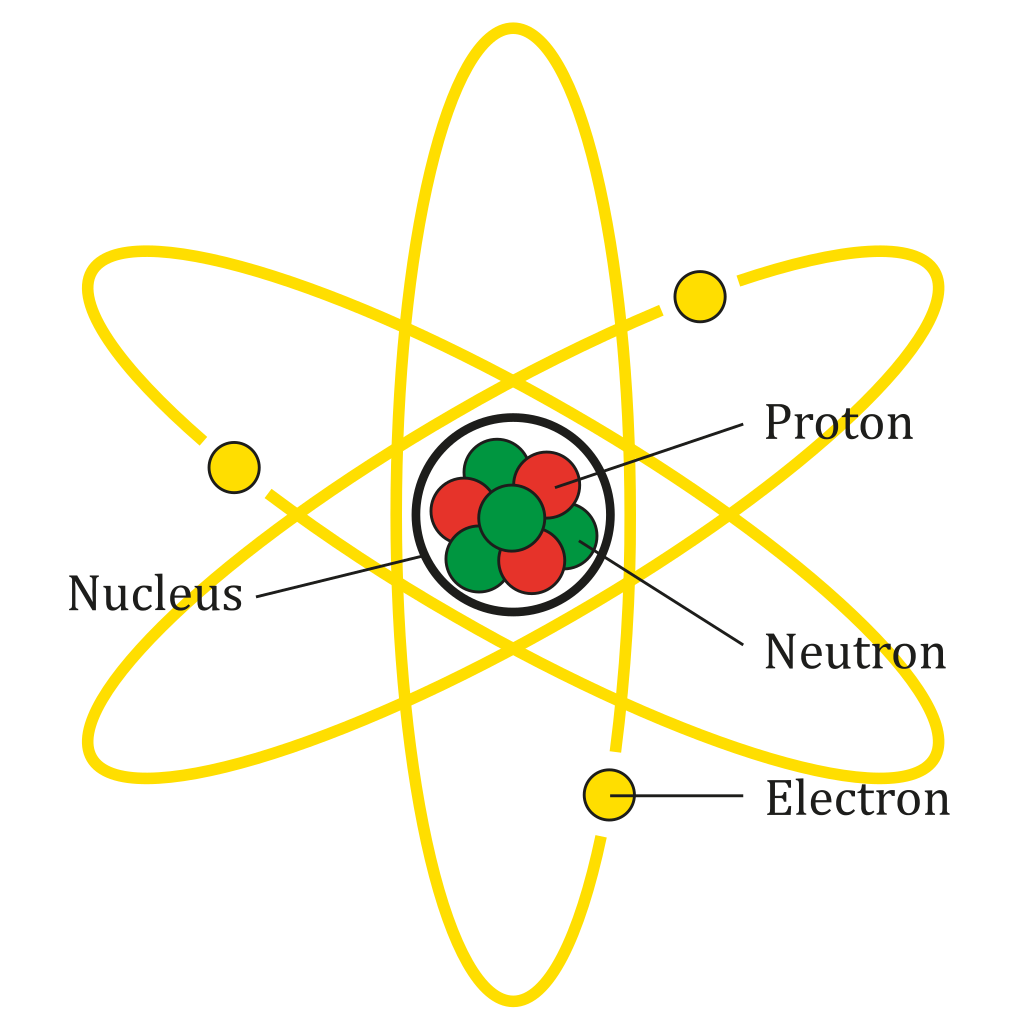
In 1910, Ernest Rutherford, un fizician din Noua Zeelanda, face diverse experimente, in cadrul carora bombardeaza diferite esantioane de materie (argint, aur, cupru), cu particule alfa si deduce ca incarcatura pozitiva trebuie sa ocupe un volum foarte mic, pe care il numeste “nucleu”, inconjurat de un invelis incarcat negativ. Prin calcule matematice, a ajuns la concluzia ca masa atomului era concentrata intr-un nucleu minuscul (de 10 000 de ori mai mic decat atomul), in timp ce electronii se roteau continuu in jurul acestuia. Modelul atomic Rutherford este valabil si astazi.
Fizicianul danez Niels Bohr, in 1922, cel care a primit si Premiul Nobel pentru cercetarile sale in domeniu, propune modelul atomic “planetar”, aratand ca, asa cum masa sistemului solar este concentrata in Soare, tot asa, cea a atomului este concentrata in nucleul incarcat pozitiv, in jurul lui orbitand electronii, precum planetele in jurul Soarelui.
In fizica nucleara moderna, se considera ca nucleul contine protoni incarcati pozitiv, precum si neutroni fara sarcina electrica, mentinuti laolalta de forte nucleare puternice. Rutherford intuise existenta neutronilor, dar, prin tehnologia din vremea sa, nu a putut sa dovedeasca decat existenta particulelor incarcate electric, nu si alte caracteristici ale acestora. Numarul electronilor din atom, care se rotesc in jurul nucleului corespunde celui al protonilor din nucleu si este acelasi cu numarul atomic al elementului din tabelul lui Mendeleev. Aceasta structura se regaseste in modelul atomic cuantic al lui Schrodinger, fizician austriac, cel care, in 1926, a formulat ecuatia care ii poarta numele (ecuatia Schrodinger), valabila pentru descrierea oricarui sistem fizic, atomic, subatomic sau macroscopic (chiar pentru intregul univers). Potrivit acestui model, electronul manifesta, ca orice structura cuantica, o dualitate unda – corpuscul, in virtutea careia se comporta si ca particula care ocupa o pozitie bine delimitata si ca o unda susceptibila de fenomene de interferenta.

Modelul atomic actual s-a imbogatit cu o multime de informatii, adunate in timp, confirmand sau completand datele deja cunoscute. Astfel, se stie ca nucleul contine 99,9 din masa atomului, ca in jurul nucleului exista un nor de electroni de 40 000 de ori mai intins decat nucleul insusi. Acesta din urma este alcatuit din protoni, particule subatomice, incarcate pozitiv, si neutroni, neutri din punct de vedere electric. Exceptie face atomul de hidrogen, al carui izotop (atom cu un numar identic de protoni, dar cu un numar diferit de neutroni), numit protiu, nu contine nici un neutron. Electronii sunt dispusi pe orbitali atomici, care interactioneaza cu nucleul prin fortele electromagnetice, in timp ce nucleonii (protoni si neutroni) sunt mentinuti impreuna prin legaturile nucleare.
Fizica nucleara defineste interactiunea forte (forta nucleara tare), de o suta de ori mai puternica decat forta electromagnetica, drept cea care are rolul de a tine protonii si neutronii integri. Pana la jumatatea secolului trecut, s-a crezut ca nu mai exista alte particule mai mici, care sa intre in alcatuirea atomului, desi, in 1931, fizicianul austriac Wolfgang Ernst Pauli intuise existenta neutrinului, rezultat din descompunerea neutronului, ceea ce s-a si dovedit ulterior. Murray Gell-Mann, fizician american, laureat al Premiului Nobel, in 1969, a completat si el modelul atomic cu identificarea quarcurilor, a caror prezenta a fost demonstrata prin bombardarea protonilor cu electroni. Quarcurile nu sunt particule libere, ci apar numai in grupuri de cate trei, au incarcatura electrica, luate separat, dar impreuna au incarcatura electrica zero, iar forta lor de coeziune este cu atat mai mare, cu cat quarcurile sunt mai indepartate unele de altele.
Desi quarcurile exista peste tot in materia care formeaza Universul, prezenta lor nu a putut fi demonstrata decat in acceleratoarele de particule (cum este cel de la Geneva – CERN – The European Organization for Nuclear Research). Mai multe quarcuri pot forma “hadroni”, iar oamenii de stiinta au avansat si alti termeni care definesc particule subatomice – bosoni (responsabili de forta nucleara slaba), gluoni (adica bosoni responsabili de interactiunea forte), leptoni (un termen care defineste electronii si neutrinii), hadroni (compusi din quarcuri si anti-quarcuri). Intr-o abordare accesibila si nespecialistilor, toate elementele din structura nucleului, mentionate anterior, ar corespunde modelului picaturii de apa, cu deosebirea ca legaturile electrice slabe dintre atomii si moleculele care formeaza picatura de apa sunt inlocuite, la nivelul nucleului, de interactiunea nucleara forte dintre nucleoni (neutroni sau protoni).

Mai multi atomi pot sa stabileasca legaturi intre ei, gratie electronilor, a caror configuratie determina proprietatile chimice ale atomului. Configuratia electronilor, la randul ei, depinde de numarul de protoni din nucleu, adica de numarul atomic, prin care se defineste orice element chimic.
Atomii reprezinta aproximativ 4% din energia observabila in Univers. In spatiul interstelar al Caii Lactee, de exemplu, concentratia de atomi variaza, in functie de anumite zone, intre o suta de mii si un miliard de atomi, pe metru cub. Stelele se formeaza din nori densi, reactiile de fuziune nucleara (dintre doua nuclee atomice) generand formarea de elemente chimice mai grele decat hidrogenul, heliul si litiul, rezultate dupa Big Bang, marea explozie care pare sa fi avut loc in urma cu peste 13 miliarde de ani. Mai mult de 95% dintre atomii Caii Lactee se gasesc in stele, 10 % din masa Galaxiei noastre fiind vizibila, restul reprezentand materie neagra (intunecata) – un concept ipotetic, invocat din necesitatea justificarii diverselor calcule. Pe Terra, majoritatea atomilor care o formeaza erau prezenti in nebuloasa (norul de gaz) din care s-a format sistemul solar.
Atomii aparuti de la acel moment incoace au provenit din dezintegrarea radioactiva a elementelor primordiale instabile, iar izotopii corespunzatori reprezinta un mijloc de evaluare a varstei Pamantului. Alti atomi au rezultat din interactiunea razelor cosmice cu atmosfera terestra, asa cum este cazul elementului Carbon 14 sau Beriliu 10. S-au obtinut atomi si in laborator, pe cale sintetica, in scopuri stiintifice, industriale sau militare – Plutoniu 239 (pentru armele nucleare), Americiu 241 (pentru detectoarele de fum), Siliciu 42 (utilizat pentru validarea anumitor structuri nucleare) etc.

Progresele facute in studierea modelului atomic sunt, intr-adevar, spectaculoase, dar, pe masura ce stiinta si tehnologia inainteaza, se deschid alte drumuri necunoscute, care pun sub semnul intrebarii mai toate teoriile formulate pana la momentul actual despre nasterea Universului.

















