Izotopii sunt atomi ai aceluiasi element, care difera prin numarul de neutroni pe care ii contin. De exemplu, helium 3 (3He), care are doi protoni si un neutron in fiecare nucleu component, si helium 4 (4He), care are doi protoni si doi neutroni, sunt doua forme diferite ale aceluiasi compus – heliu.
Deuteriul si tritiul sunt izotopi ai hidrogenului etc. Aproape toate elementele prezente in natura sunt mixturi ale acestor forme diferite, cu proprietati chimice aproximativ identice, dar care difera prin efectele izotopice asupra vitezei de reactie – unele reactii chimice sunt totale, rapide si violente (precum exploziile), altele sunt lente.
Descoperirea izotopilor
Pana la finalul secolului al XVIII-lea, erau cunoscute foarte multe dintre aspectele referitoare la combinarea elementelor chimice. De exemplu, in acea perioada, se stia ca, daca un element A, de un gram, se combina cu un element B, de 10 grame, atunci 2 grame din compusul A vor reactiona cu 20 de grame din compusul B. Acest fenomen a fost explicat in anul 1803, de catre chimistul John Dalton, care a sugerat ca toata materia este alcatuita din particule minuscule, care poarta denumirea de atomi.
Teoria lui Dalton presupunea ca toti atomii unui element sunt identici, ca greutate, dar diferiti in privinta compozitiei lor (o teorie care precede descoperirea izotopilor). Prin masurarea diferitelor substante care participau la reactiile chimice, a fost posibila identificarea greutatii atomice, cunoscuta si sub denumirea de masa atomica relativa. Greutatea atomica a unui element este, de fapt, greutatea unui element comparata cu cea a unui atom de hidrogen. In anul 1815, William Prout, chimist si fizician englez, observa ca majoritatea greutatilor atomice erau numere intregi, de unde trage concluzia ca greutatea fiecarui atom in parte era aproape identica cu multiplii unui singur atom de hidrogen.
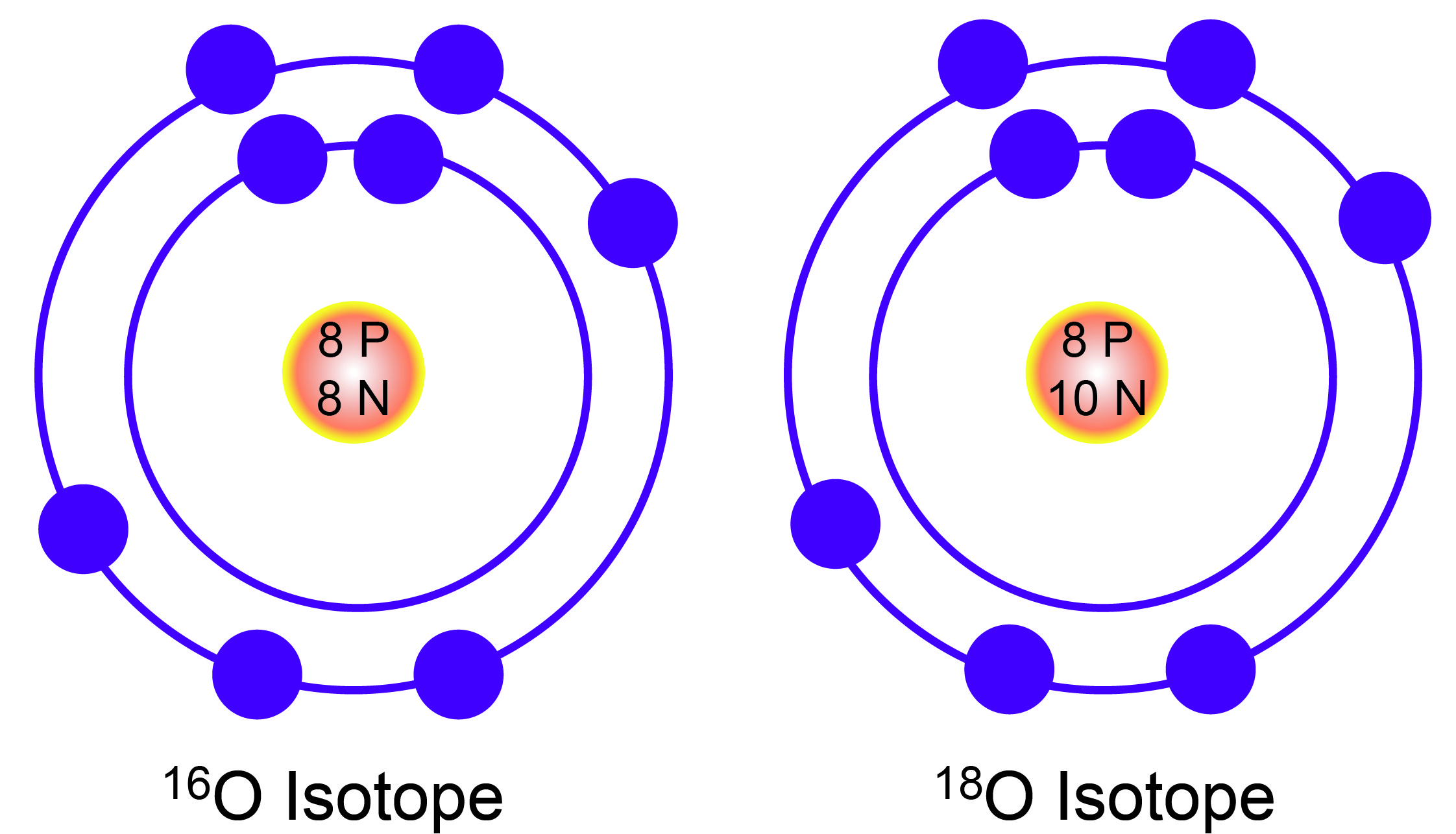
De exemplu, atomul de azot este de 14 ori mai greu decat atomul de hidrogen, iar atomul de oxigen, de 16 ori mai greu. In momentul in care masuratorile au devenit mai precise, cercetatorii au mai putut observa ca greutatea atomica nu este intotdeauna un numar intreg, clorul, de exemplu, avand o greutate de 35.5. De abia in secolul al XX-lea, oamenii de stiinta din domeniu au facut descoperiri importante legate de structura atomilor individuali, gasind si o explicatie pentru greutatile lor moleculare.
In anul 1897, cercetatorul J. J. Thompson descopera electronul, iar in 1911, Ernest Rutherford constata ca atomul este alcatuit dintr-un miez incarcat pozitiv, care poarta denumirea de nucleu, inconjurat de catre mai multi electroni, incarcati negativ. Sarcina pozitiva a nucleului este egala cu suma sarcinilor negative ale electronilor. In anul 1913, H. G. J. Mosely stabileste numarul atomic al catorva elemente, dar nu si izotopii.
Comportamentul chimic al unui atom este dat de numarul, dar si de dispunerea electronilor, greutatile atomice determinand doar cantitatea din fiecare element care participa la o reactie chimica. Aceasta este si motivul pentru care pot exista doi atomi ai unui singur element, cu greutati atomice diferite, dar cu proprietati chimice identice.
Atomii respectivi poarta denumirea de izotopi. Cercetatorul Francis W. Aston, in 1919, folosind un spectograf de masa, a separat si izolat izotopi ai unor elemente diferite. In procesul de spectroscopie este posibila separarea atomilor cu diferite greutati atomice si determinarea procentului acestor atomi in componenta fiecarui element.
De exemplu, clorul are doi astfel de atomi cu proprietati chimice identice, cu greutati atomice de 35 si 37. In anul 1932, fizicianul englez James Chadwick descopera neutronul (pentru care a primit Premiul Nobel), moment in care devine din ce in ce mai clar ca nucleul unui atom este alcatuit din protoni (particule cu masa egala cu unu, transportand o singura sarcina pozitiva) si din neutroni.
Astfel, nucleul heliului, care are o greutate atomica de 4 si un numar atomic de 2 este alcatuit din 2 neutroni si 2 protoni. Nucleul izotopului clorului cu greutate 35 este alcatuit din 17 protoni si 18 neutroni, in timp ce atomul cu proprietati chimice identice, dar cu greutate 37, este alcatuit din 17 protoni si 20 de neutroni, numarul atomic al ambilor atomi cu proprietati chimice identice fiind de 17.
Utilizari ale izotopilor
Descoperirea izotopilor este folositoare nu doar in chimie, ci si in foarte multe alte domenii, cum ar fi armele nucleare si energia electrica.
In medicina, izotopii sunt folositi pentru studierea efectului metabolismului animal in procesarea alimentelor, in radiologie si radioterapie, la tratarea dferitelor tipuri de neoplasme.
Izotopii intra si in componenta detectoarelor de fum instalate in cladiri.
Arheologii folosesc datarea cu carbon 14 (radioactiva), pentru a determina varsta unui obiect, folosind izotopul atomului de carbon mentionat anterior.
In domeniul evaluarii mediului ambiant, analiza izotopica a unui organism, a solului sau a diverselor sedimente ajuta la identificarea zonelor contaminate cu metale (de exemplu, cu plumb). Se poate stabili, de asemenea, sursa unei poluari.
In anchetele criminalistice, prin analiza izotopica, se pot afla marca si originea unui glont, pornind de la un esantion de plumb.
In industria alimentara se poate analiza, cu precizie, tipul de hrana al unui animal, a carui carne este comercializata, se pot diferentia feluri de vinuri, sucuri de fructe, miere, lapte, branzeturi etc.